1.日本における国際共同治験データの取り扱いの変遷
2.日本での申請を目的としたアジア開発
アジア開発については、2012年に発出された「国際共同治験に関する基本的考え方(参考事例)」の中で東アジア地域での国際共同治験に関する留意事項が示されましたが、「東アジア地域で実施する治験であっても、欧米諸国と実施する国際共同治験の場合と同様に、民族的要因の差異が医薬品の有効性及び安全性に及ぼす影響について予め十分 に検討した上で、国際共同治験を計画し実施する必要がある」とされ、「今後、東アジア地域における科学的データや情報をより集積し検討することで、民族的要因の差異に関する理解が深まり、東アジア地域における国際共同治験をより円滑かつ適切に実施することにつながると考えられる。」との期待感が示されただけにとどまりました。
E17ガイドラインでは、「地域」及び「地域の併合戦略」の考え方が示されましたが、「併合戦略は、治療効果や対象疾患に影響を及ぼすことが知られている内因性・外因性民族的要因の分布、これらの民族的要因の地域間の類似性に基づいて、正当化されるべきである。」 とされており、事前情報により正当化したうえで、治験実施計画書及び統計解析計画書に明記することが求められています。
3.日本における国際共同治験の増加
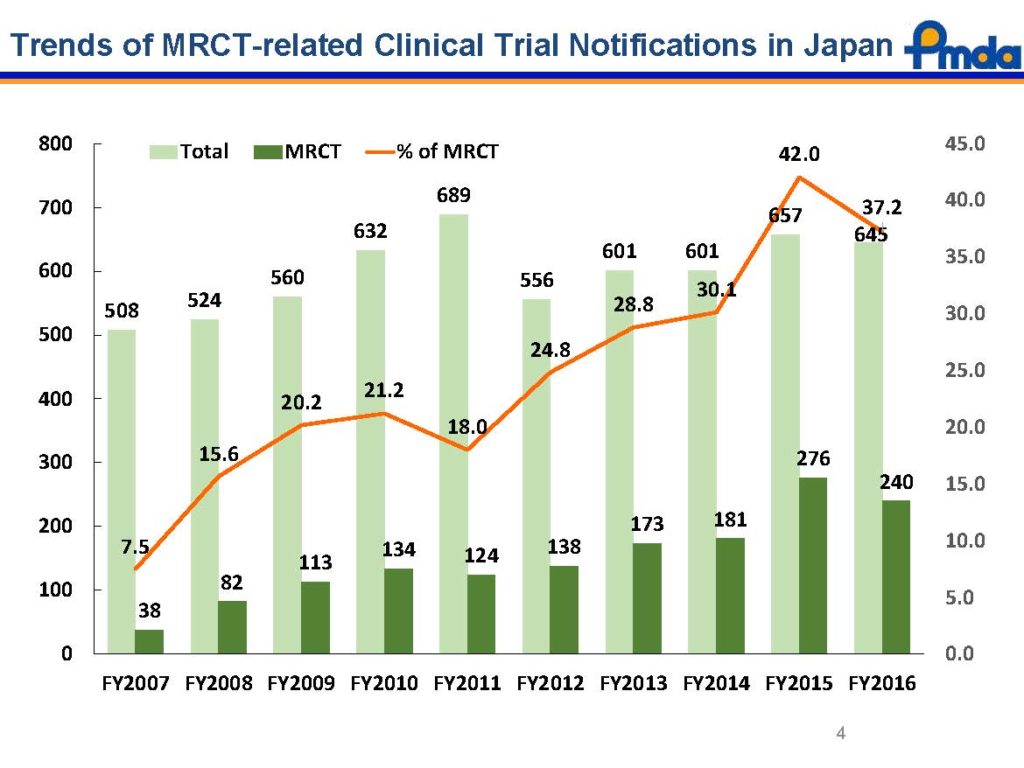
日本における国際共同治験(MRCT: Multi-Regional Clinical Trials) 届出(CTN: Clinical Trial Notification)のトレンド
全体の治験届出数はほぼ一定数で推移していますが、その中での国際共同治験の割合は年々増加の傾向を示しています。
日本における国際共同治験(MRCT: Multi-Regional Clinical Trials)に基づく承認申請(NDA: New Drug Application) のトレンド
全体の承認申請数はほぼ一定数で推移していますが、その中で国際共同治験に基づく申請の割合は際立って増加しています。それに対してアジア開発に基づく申請割合はそれほど大きく増えてはいません。