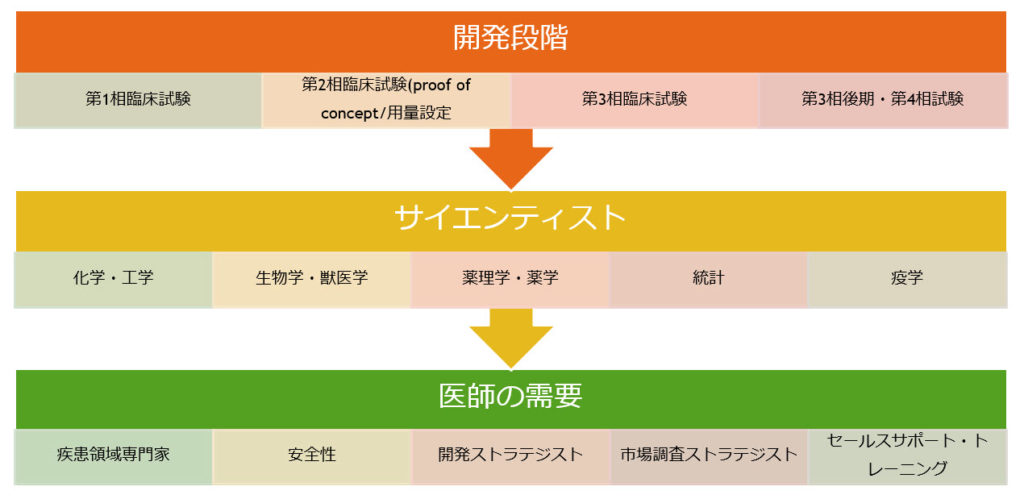
医薬品開発は一般的に以下の流れで行われます。
基礎研究
くすりの開発は、将来くすりとなる可能性のある新しい物質(成分)を発見したり、化学的に創り出すための研究から始まります。天然素材(植物・動物・微生物など)からの抽出や、合成、バイオテクノロジーなどの多様な科学技術を駆使した手法が用いられます。最近はゲノム情報の活用も進められています。さらに新規物質の性状や化学構造を調べ、スクリーニング(ふるい分け)にかけて取捨選択します。
非臨床試験
くすりとして可能性のある物質を対象に、動物や培養細胞を用いて、有効性と安全性を研究します。また、その物質の動態(吸収・分布・代謝・排泄の過程)や、品質、安定性に関する試験も行います。
中でも安全性に関する非臨床試験については、適切に行われる必要があるため、国際的に調和されたガイドラインが定められています。
臨床試験(治験)
基礎研究により見出された「くすりの候補」が実際に人で効果(有効性)があるか、安全性(副作用)は効果と比べて許容範囲かどうかを調べるために、人での臨床試験(治験)を実施します。治験は、科学的な方法で、参加される方の人権を最優先にして行わなければなりません。
治験を実施する際に守るべきルールをGCP(Good Clinical Practice)といい、日本では厚生労働省令「医薬品の臨床試験の実施の基準に関する省令」で定められています。この規則は欧米諸国をはじめ国際的に認められています。
品質
基礎研究、非臨床試験、臨床試験、市販後を通じ、有効成分および製剤の品質を担保することが重要です。
品質に関しても国際調和されたガイドラインが制定されています。